PI-OKBH-45 Příprava a barvení nátěrů periferní krve, IKK
Dle doporučení ČHS, ČLS
JEP-Příprava a barvení nátěru periferní krve a aspirátu kostní dřeně, 2019
Princip: Pappenheimova
panoptická barvící technika
Panoptická barvicí technika je
základní postup barvení v hematologii. Využívá k postupnému
barvení nátěrů:
§
roztok May-Grünwald – složení: eozin Y,
metylenová modř, metylalkohol, glycerol,
§
roztoku Giemsa-Romanowsky – složení: metylenová
modř, azur-eozin, azur II, metylalkohol, glycerol.
Základem jsou:
- kationtové
(zásadité) barvivo azur B, které se váže na aniontové části molekul a
barví modrošedě DNA nebo RNA, nukleoproteiny, granule bazofilů a
sekundární granula neutrofilů.
- aniontové barvivo eozin Y, které se váže na kationtové části molekul
proteinů a barví oranžovočerveně hemoglobin a eozinofilní granula.
Odběr a manipulace s biologickým materiálem:
Periferní krev odebraná do K3EDTA, nativní aspirát kostní
dřeně
Stabilita vzorku do zhotovení nátěru max. 5 hodin.
Uchovávání nátěru na skle:
- nefixovaný nenabarvený nátěr vhodné zpracovat do 5 hodin
- nabarvený
nátěr PK uchováváme po dobu 1 měsíce
Tzv. rychlé barvení není vhodné k barvení nátěrů při hodnocení
periferní krve.
Základní reagencie
-roztok May-Grünwald (Penta)
-roztok Giemsa-Romanowsky (Giemsa
R Solution, Penta)
- uchovávat při laboratorní
teplotě ve tmě, používat do data exspirace
-fosfátový pufr pH =7,0 (Buffer Solution
f.Diagnostika a.s.)
- uchovávat při laboratorní
teplotě, stabilita 4 týdny po rozpuštění
Postup:
1.
Zhotovování
krevních nátěrů:
§
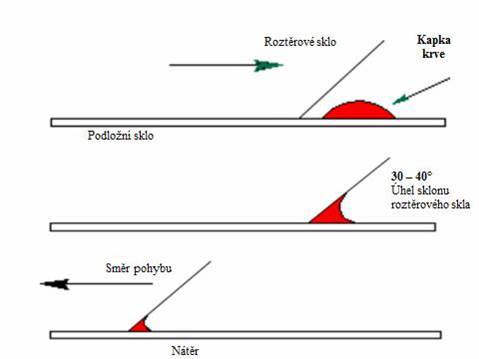
Na podložní sklíčko nanést kapku krve z odběrové
zkumavky.
§
Roztěrové sklíčko přiložit pod úhlem 30-40 °
před kapku, zhotovit nátěr rovnoměrným a lehkým pohybem směrem ke kapce a pak
k opačnému konci podložního sklíčka. Nátěr musí být rovnoměrný, stejnorodý
a přiměřeně tenký, musí mít dlouhé rovné okraje a na konci přecházet do
ztracena, alespoň 1-
§
Hotový nátěr nechat min.10 min.na vzduchu dobře
zaschnout, přičemž je nutné ho chránit před znečištěním prachem.
§
Sklíčko označit identifikačním číslem, datem a
jménem pacienta
§ Nátěry krve ne sklíčku necháme 10 minut
zaschnout při laboratorní teplotě a pak barvíme.
2.
Barvení
krevních nátěrů:
- Použít Pappenheimovu metodu
panoptického barvení roztokem May-Grünwald a Giemsa-Romanowski.
- Podložní sklíčka s nátěry
vložit do barvicí kyvety s neředěným May-Grünwaldovým roztokem (nesmí
přijít do kontaktu s vodou) a fixovat 5 min., vyměňovat dle potřeby.
- Nátěry vložit do barvící kyvety
s pufrem na 1 min., vyměňovat dle potřeby.
- Pak nátěry vložit do kyvety s
ředěným roztokem Giemsa-Romanowski 1:20 s pufrem a barvit 10 min,
připravovat denně čerstvý.
- Opláchnout pod mírným proudem
tekoucí vody a nechat oschnout
Kontrola kvality:
Dodržování
SOP H_Hodnocení nátěru PK
Požadavky na kontrolu
kvality při hodnocení krevních nátěrů prováděné denně:
- dodržování standardních operačních postupů
- kontrola dodržení časových charakteristik (včasná
fixace, délka barvení)
- používat čerstvě naředěné barvící roztoky, ne déle
než 24 hod., kontrola dostatečného množství
roztoků
v kyvetách, kyvety uzavírat
- dodržovat podmínky skladování (barvící roztoky
uchovávat ve tmě, dodržovat teplotu) a dobu exspirace reagencií
- zamezení vlhkosti v roztocích
- kvalita skel (nepoužívat poškozená, zašpiněná, mastná
skla)
- správné provedení nátěru (délka, šířka a síla)
- kontrola pufru-bez viditelných příměsí a změn
- kontrola po nabarvení nátěru s každou novou
sérií barvících roztoků a v první sadě skel (1-2 skla), číslo
kontrolního vzorku zaznamenat do formuláře
F-OKBH-123 Příprava barev-dif.mikro,
záznamy autorizovat
1. Makroskopicky: - krevní
nátěry mají být zbarveny purpurově
- je-li zbarvení do modra, pufr má vyšší pH
nebo je přebarvený
- je-li zbarvení do růžova, pufr má nižší pH
nebo je nátěr nedobarvený
2. Mikroskopický:
erytrocyty růžovošedé
trombocyty
tmavě růžové
leukocyty-jádra tmavě fialová
eozinofily-granula
jasně oranžová
neutrolily
a granulované lymfocyty-granula purpurová
bazofilní
tečkování erytrocytů modré
- hodnocení
nátěru se provádí dle SOP, na službách při prvozáchytu patologie
v KO je nutné provést mikroskopické hodnocení nátěru PK,v případě
nejasností kontaktujte EM,KV,GD
- výsledky hodnocení se zapisují do pracovního
listu a autorizují
Při
nedostatečné kvalitě je připravena nová barvící lázeň a zkontrolována opět
zhotovením a zhodnocením
krevního
nátěru.
Zbarvení nátěrů je dáno:
- Vlastním barvením a barvicími roztoky,
- Typem biologického materiálu (periferní krev,
kostní dřeň, atd.)
- Vlastnostmi biologického materiálu (vysoký či
nízký hematokrit, paraproteinémie, buněčnost)
Jestliže jsou na nátěrech patrné
rozdíly v barvitelnosti buněk (viz výše) ve
stejném barvicím cyklu a ve
stejné barvicí lázni, potom je barvení v pořádku a změny
v obarvení jednotlivých nátěrů
jsou dány typem odebraného biologického materiálu (výsledek
barvení může být ovlivněn i
buněčným složením).
Uchovávání
nátěrů:
- Nenabarvené, nefixované – vhodné zpracovat do
5 hodin,
- Nenabarvené, fixované – je možné uchovávat po
neomezenou dobu (nátěry periferní krve nejlépe po dobu 1 měsíce, aspiráty
kostních dření po dobu 10 let),
- Nabarvené – je možné uchovávat po neomezenou
dobu (nátěry periferní krve minimálně 7 dní, aspiráty kostních dření po
dobu 10 let). Uchováváme po dobu 1 měsíce.
Pro uchovávání obarvených
nátěrů je nezbytné zbavit nátěr imerzního oleje oplachem nebo otěrem (šetrný
prostředek je např. ether nebo benzín lékařský).
Kontrola
zařízení:
- 1x ročně validace a seřízení mikroskopu
servisním technikem
- objektivy čistit po každém použití
Dokumentace:
- o kontrole zařízení provádět záznam do
provozního deníku, záznam autorizovat
- záznam o kontrole kvality, přípravě barvících
roztoků, fosfátového pufru, změně šarže zkoumadel a pufru provést do
formuláře F-OKBH-123
Příprava barev-dif.mikro, záznam autorizovat
Zdroje chyb
§ Silný
nátěr po celé délce skla.
- Sklo nebylo řádně odmaštěné (v nátěru jsou mastná
oka).
- Sklo nebylo přikryté, je pokryté prachovými
částicemi (nátěr je strakatý).
- Nátěr je ukončen silnou vrstvou a nepřechází „do
ztracena“ (roztěrové sklo bylo při
ukončení
nátěru prudce zvednuto).
- Nátěr s nerovnoměrně rozloženými jadernými
buňkami (na roztěrové sklo se příliš
tlačilo, nátěr
byl proveden pod tlakem, a proto může dojít k rozdrcení buněk, příp. bylo
nekvalitní roztěrové sklo).
- Nesprávný sklon roztěrového skla (nesprávná
hustota nátěru, roztěr nebyl proveden dle hodnot HCT).
Zdroje chyb při barvení:
- Kyselé pH způsobí růžové zbarvení nátěrů,
zásadité pH modré zbarvení nátěrů.
- Dojde-li při oplachování nátěru k jeho „smytí“,
znamená to, že nátěr nebyl dostatečně
zaschlý nebo
fixovaný.
- Staré krevní nátěry či nátěry aspirátu KD bývají
často přebarvené.
- Modré pozadí nátěru (mimo buňky) může být
způsobeno
-
nedostatečnou fixací,
-
nedostatečným oplachem,
- dlouhodobým skladováním
nefixovaného nátěru,
- přítomností
patologických imunoglobulinů ve vzorku.
Vnitřní kontrola kvality mikroskopického hodnocení nátěru periferní
krve jednotlivých pracovníků:
- Jako referenční materiál se využívají nátěry PK
použité v EHK.
- VKK se účastní všichni pracovníci, kteří provádí a
jsou zodpovědní za mikroskopické hodnocení nátěru periferní krve.
- Výsledky každého pracovníka jsou zhodnoceny vůči
vydaným výsledkům EHK, hodnocení pracovníků je zapsáno do formuláře F-OKBH-121 VKK pro mikroskopické hodnocení
- Výsledky společně s primárními daty jsou
archivovány u vedoucího úseku
Externí
hodnocení kvality (EHK)
4x ročně se laboratoř
účastní cyklu zaměřeného na hodnocení rozpočtu leukocytů a hodnocení buněk
v nátěru periferní krve a 2x ročně hodnocení nátěru periferní
krve-fotografie.